ΦΡΟΝΤΙΣΤΗΡΙΟ "ΚΕΝΤΡΟΝ" Υψηλάντου 11 ΚΑΡΔΙΤΣΑ τηλ. 6973774834 35ος χρόνος διδάσκοντας Χημεία...
Δευτέρα 31 Δεκεμβρίου 2018
Δευτέρα 24 Δεκεμβρίου 2018
Τετάρτη 19 Δεκεμβρίου 2018
Γ΄Λυκείου: Τροχιακά s, p, d, f ... και η κυματοσυνάρτηση Ψ
1. Δείτε για τις στιβάδες Κ, L δηλ. για τις υποστιβάδες 1s, 2s, 2p πως επικαλύπτονται τα τροχιακά τους: 1s, 2s, 2px, 2py, 2pz:
2. Παρακάτω μπορείτε να δείτε τα d τροχιακά:
3. Δείτε τώρα το απίθανο: Από το 1s έως το 3d τροχιακό. Πως ο ένας χώρος επικαλύπτει τον άλλο.
και μετά ...μουσικής:
4. Δείτε παρακάτω τα d τροχιακά:
5. Ακολουθούν τα f τροχιακά:
6. Τα g τροχιακά...
7. Για την κυματοσυνάρτηση Ψ:
ΣΧΟΛΙΚΟ ΒΙΒΛΙΟ: Οι κυματοσυναρτήσεις ψ που αποτελούν λύσεις της εξίσωσης Schrodinger, για το άτομο του υδρογόνου, ονομάζονται ατομικά τροχιακά.
Τα ατομικά τροχιακά αποτελούν συναρτήσεις της θέσης του ηλεκτρονίου στο άτομο δηλ. είναι είναι της μορφής ψ(x,y,z) όπου x, y, z είναι οι συντεταγμένες που καθορίζουν τη θέση του e γύρω από τον πυρήνα.


ΣΧΟΛΙΚΟ ΒΙΒΛΙΟ: Οι κυματοσυναρτήσεις ψ που αποτελούν λύσεις της εξίσωσης Schrodinger, για το άτομο του υδρογόνου, ονομάζονται ατομικά τροχιακά.
Τα ατομικά τροχιακά αποτελούν συναρτήσεις της θέσης του ηλεκτρονίου στο άτομο δηλ. είναι είναι της μορφής ψ(x,y,z) όπου x, y, z είναι οι συντεταγμένες που καθορίζουν τη θέση του e γύρω από τον πυρήνα.
Δείτε λοιπόν τι είναι τα x,y,z:
Από την εξίσωση Schrodinger π.χ. για
n=2, l=1, ml=0 προκύπτει η κυματοσυνάρτηση ψ(2pz) που περιέχει τις
μεταβλητές r,θ,φ. Το τρισδιάστατο γράφημα του τετραγώνου της ψ(2pz) ως
προς τις γωνίες θ,φ δίνει τον γνωστό αλτήρα στον άξονα z (στον οποίο
υπάρχει πιθανότητα 90-99 % να βρεθεί το e).
Αυτό το σύνολο σημείων που υπάρχει πιθανότητα να βρεθεί το e λέγεται ηλεκτρονιακό νέφος 2pz ή απλά τροχιακό 2pz (γι αυτό τη φράση ατομικό τροχιακό κανονικά πρέπει να την κρατάμε μόνο για το ψ).
Αν στη εξίσωση Schrodinger η τριάδα τιμών n,l, ml δεν είναι επιτρεπτή τότε προκύπτει ψ=0 (απουσία e).
Γ΄Λυκείου: Αρχή αβεβαιότητας του Heisenberg (1927)
 |
| Werner Karl Heisenberg (5 December 1901 – 1 February 1976) |
Μετρήσεις και Αρχή της Αβεβαιότητας
Σ’ όλες τις μετρήσεις που κάνουμε στην καθημερινή μας ζωή υπεισέρχονται κάποια σφάλματα, υπάρχει δηλαδή κάποια αβεβαιότητα. Την αβεβαιότητα αυτή μπορούμε να την ελαττώσουμε, αν στις μετρήσεις μας χρησιμοποιήσουμε όργανα μεγαλύτερης ακρίβειας. Για παράδειγμα, ένα ρολόι χειρός που στη ζυγαριά του παντοπωλείου ζυγίζει 50 g, σ’ έναν απλό εργαστηριακό ζυγό δείχνει να έχει μάζα 47,35 g και στον αναλυτικό ζυγό 47,3482 g. Θα περίμενε έτσι κανείς ότι αυξάνοντας συνεχώς τον βαθμό της ακρίβειας ενός οργάνου μετρήσεως η αβεβαιότητα στη μέτρηση να γίνεται απεριόριστα μικρή. Έρχεται όμως ο Heisenberg με την αρχή της αβεβαιότητας και βάζει ένα όριο στην ακρίβεια των μετρήσεων, όπως κάποτε ο Δημόκριτος με τον όρο άτομο έθεσε φραγμό στη συνεχή κατάτμηση της ύλης. Το όριο αυτό του Heisenberg δεν σημαίνει ότι υπάρχει περιορισμός στην τεχνολογική εξέλιξη των οργάνων μετρήσεων, περισσότερο έχει την έννοια ότι πρόκειται για κάτι έμφυτο, δηλαδή κάτι που υπάρχει στη φύση. Για αντικείμενα του μακροκόσμου το όριο του Heisenberg δεν έχει πρακτικά καμιά απολύτως συνέπεια. Όμως, για υποατομικά σωματίδια, όπως το ηλεκτρόνιο, η σημασία αυτού του ορίου είναι τεράστια.
Για να κατανοήσουμε την αρχή της αβεβαιότητας του Heisenberg ας φανταστούμε την εξής εικόνα. Βρισκόμαστε σ’ ένα σκοτεινό δωμάτιο και με τη βοήθεια ενός φακού τσέπης προσπαθούμε να εντοπίσουμε τη θέση μιας μπάλας του μπάσκετ που κυλάει στο πάτωμα. Κάποια στιγμή η δέσμη του φωτός πέφτει πάνω στη μπάλα, το φως σκεδάζεται και η μπάλα γίνεται ορατή στα μάτια μας. Σ’ αυτή τη διαδικασία η μπάλα δεν «ενοχλήθηκε» καθόλου, αφού η δέσμη των φωτονίων που έπεσε επάνω της δεν άλλαξε ούτε τη θέση της ούτε την ορμή της. Φαντασθείτε τώρα ότι με ανάλογο τρόπο θέλετε να προσδιορίσετε τη θέση ενός ηλεκτρονίου που κινείται με ταχύτητα υ. Το ηλεκτρόνιο θα πρέπει να «φωτισθεί» και κάποιο από τα φωτόνια που σκεδάζονται να γίνει αντιληπτό από το «μάτι» ενός ανιχνευτή (μικροσκόπιο παρατηρήσεως).
Όμως σε μια τέτοια μέτρηση υπεισέρχονται σφάλματα λόγω περίθλασης. Για να έχουμε μεγάλη ακρίβεια στον προσδιορισμό της θέσεως του ηλεκτρονίου θα πρέπει τα σφάλματα αυτά να είναι μικρά και για να είναι μικρά θα πρέπει το φως που χρησιμοποιούμε για να «φωτίσουμε» το ηλεκτρόνιο να έχει όσο δυνατόν μικρότερο μήκος κύματος.
Μικρό μήκος κύματος σημαίνει μεγάλη συχνότητα και μεγάλη ενέργεια για τα φωτόνια που πέφτουν πάνω στο ηλεκτρόνιο. Με τη σειρά της η μεγάλη ενέργεια των φωτονίων προσδίδει μεγάλη ορμή στο ηλεκτρόνιο, του οποίου πλέον η κίνηση μεταβάλλεται κατ’ απρόβλεπτο τρόπο. Έτσι βλέπουμε ότι προσπαθώντας να ελαττώσουμε τα σφάλματα, δηλαδή να αυξήσουμε την ακρίβεια στον προσδιορισμό της θέσεως του ηλεκτρονίου, ελαττώνουμε την ακρίβεια στον προσδιορισμό της ορμής του. Αυτό αποτελεί την ουσία της αρχής της αβεβαιότητας: Υπάρχει πάντα μια αβεβαιότητα είτε στη θέση είτε στην ορμή του ηλεκτρονίου που δεν μπορεί να μειωθεί κάτω από ένα συγκεκριμένο όριο.
Μολονότι ποτέ δεν μπορούμε να γνωρίζουμε την ακριβή θέση και ορμή του ηλεκτρονίου, εντούτοις μπορούμε να μιλάμε για την πιθανότητα εύρεσης του ηλεκτρονίου σε ορισμένες θέσεις στο χώρο.
Το πείραμα που εισήχθηκε από τον Heisenberg και το οποίο βοηθάει να ξεκαθαριστεί αυτή η ιδέα, δίνεται από την παρακάτω απεικόνιση. Για να δει κάποιος ένα ηλεκτρόνιο, και να καθορίσει έτσι τη θέση του, μπορεί να χρησιμοποιήσει ένα ισχυρό μικροσκόπιο φωτός. Για να είναι το ηλεκτρόνιο ορατό, πρέπει τουλάχιστον ένα φωτόνιο του φωτός να συγκρουστεί με αυτό, και να περάσει έπειτα μέσω του μικροσκοπίου στο μάτι μας.
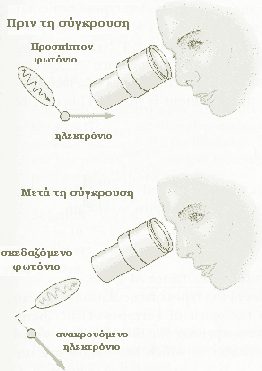 |
Ένα πρόβλημα όμως εμφανίζεται εδώ: το φωτόνιο μεταφέρει κάποιο άγνωστο ποσό ορμής του στο ηλεκτρόνιο. Κατά συνέπεια, στο στάδιο της εύρεσης μια ακριβούς θέσης του ηλεκτρονίου (κάνοντας το Δx πραγματικά μικρό), το ίδιο φως που μας επιτρέπει να το δούμε αυτό, αλλάζει την ορμή του ηλεκτρονίου σε μια απροσδιόριστη έκταση, κάνοντας το Δp πολύ μεγάλο.
Αν χρησιμοποιήσουμε φωτόνιο χαμηλής συχνότητας, το μήκος κύματος του θα περιορίσει την ακρίβεια με την οποία θα εντοπίσουμε το ηλεκτρόνιο. Από την άλλη μεριά ένα φωτόνιο μικρού μήκους κύματος δίνει καθαρότερη εικόνα αλλά θα προκαλέσει μια διατάραξη στην ορμή του ηλεκτρονίου, αφού έχει μεγάλη συχνότητα άρα και μεγάλη ορμή.
Τα δύο είδη λοιπόν φωτονίων δίνουν αμοιβαίως αποκλειόμενα αποτελέσματα. Υπάρχει λοιπόν καθορισμένο όριο στην ακρίβεια της γνώσης μας για τις υποατομικές καταστάσεις.
Μία άλλη εκδοχή είναι το video:
 |
| Ακρίβεια στη μέτρηση της υ => σφάλμα στη μέτρηση της θέσης |
 |
| Αντίθετα: ακρίβεια στη μέτρηση τη θέσης => σφάλμα στη μέτρηση της υ |
Γ΄ Λυκείου: Υλοκυματική θεωρία του de Broglie (1924)


Louis De Broglie
"Στο ηλεκτρόνιο συνυπάρχουν το σωματίδιο και το κύμα"
Κάθε κινούμενο μικρό σωματίδιο (π.χ. το e) είναι και κύμα (έχει f και λ) και σωματίδιο (έχει ορμή p=m*υ)
 |
| Κάθε κινούμενο μικρό σωματίδιο π.χ. το e παρουσιάζει διττή φύση: σωματίδιο (έχει ορμή p=mu) και κύμα (έχει f και λ) |
Η φύση του φωτός, του ηλεκτρονίου και άλλων μικρών σωματιδίων είναι μία, δηλ. δεν αλλάζει συνεχώς, και ανάλογα με τις πειραματικές συνθήκες άλλοτε εκδηλώνεται ο σωματιδιακός και άλλοτε ο κυματικός χαρακτήρας. Δείτε τα παρακάτω παραδείγματα:
α) Τι βλέπετε μία νέα κοπέλλα ή μία γριά;

β) Τι βλέπετε ένα σαξοφωνίστα ή ένα γυναικείο πρόσωπο;

Απλά συνυπάρχουν και τα δύο...
Mία σχετική προσομοίωση για τη θεωρία του de Broglie εδώ
Σάββατο 15 Δεκεμβρίου 2018
Σεμινάριο Διδακτικής Χημείας (ΟΕΦΕ 2018)

7ο Σεμινάριο Διδακτικής - Ο.Ε.Φ.Ε. - Σύλλογος Εκπαιδευτικών Φροντιστών Θράκης
Αλεξανδρούπολη, 17/11/2018 - Φυσικές Επιστήμες
Εισηγητής : Ανέστης Θεοδώρου
Τίτλος: Σηµεία της ύλης που δυσκολεύουν τους µαθητές στο µάθηµα «Χηµεία Γ’
Γενικού Λυκείου (Οµάδα Προσανατολισµού Θετικών Σπουδών)».
Παραδείγµατα και προτάσεις αντιµετώπισης.
Κατεβάστε από ΕΔΩ
Εισηγητής: Φιλλένια Σιδέρη
Τίτλος: Η δύσκολη και αβέβαιη μετάβαση από την άσκηση στο χαρτί, στην άσκηση του μυαλού
Κατεβάστε από ΕΔΩ
Το νέο σύστημα εισαγωγής στην Τριτοβάθμια Εκπαίδευση και τις αλλαγές στο Λύκειο
Το Σχέδιο Νόμου θα κατατεθεί , προς ψήφιση, στη Βουλή τον Γενάρη
1. Από πότε θα ισχύσει το νέο σύστημα πρόσβασης στα ΑΕΙ
Οι αλλαγές θα ισχύσουν από το 2019 – 2020. Δηλαδή το νέο σύστημα θα το εγκαινιάσουν οι μαθητές που φοιτούν στη Β Λυκείου, το τρέχον σχολικό έτος 2018-19.
2. Τα Προγράμματα Σπουδών θα είναι τα σημερινά;
Το υπουργείο Παιδείας με το Ινστιτούτο Εκπαιδευτικής Πολιτικής επεξεργάζονται νέα προγράμματα σπουδών για το γ Γυμνάσιο και για την Α’ και Β’ Λυκείου.
3. Οι εκπαιδευτικοί θα επιμορφωθούν επί των νέων δεδομένων;
Θα θεσμοθετηθεί το Εθνικό Σχέδιο Επιμόρφωσης των Εκπαιδευτικών, μέσα από το οποίο θα γίνει η σχετική επιμόρφωση.
4. Ποιος ο ρόλος της Β και Γ Λυκείου;
Στη Β Λυκείου θα ολοκληρώνονται οι εγκύκλιες σπουδές και στη Γ Λυκείου ο μαθητής θα αποκτά έναν χαρακτήρα προπαρασκευαστικής τάξης για την εισαγωγή στην Ανώτατη Εκπαίδευση.
5. Οι αλλαγές αυτές αφορούν και τα ΕΠΑΛ;
Οι προτάσεις αυτές θα ισχύουν για το Γενικό Λύκειο, ενώ για τα Επαγγελματικά Λύκεια τα πράγματα θα συνεχίσουν να έχουν όπως είναι σήμερα.
6. Ποιες αλλαγές θα έχουν στη Β Λυκείου κατά το νέο σχολικό έτος 2018-19;
Στη Β Λυκείου το μόνο που θα αλλάζει από φέτος είναι ότι το μάθημα της Πολιτικής Παιδείας θα αντικατασταθεί από το μάθημα Πολίτης και Δημοκρατία και με το αντίστοιχο εγχειρίδιο και από του χρόνου θα υπάρχουν οι άλλες σχετικές αλλαγές.
7. Ποιες αλλαγές θα ισχύσουν από του χρόνου στη Γ Λυκείου;
Οι τρεις Ομάδες Προσανατολισμού, γίνονται τέσσερις, κάθε μία από τις οποίες αντιστοιχεί σε ένα Επιστημονικό Πεδίο.
8. Σε μαθήματα;
Αντικαθίσταται το μάθημα των Λατινικών με το μάθημα της Κοινωνιολογίας. Το μάθημα των Αρχών της Οικονομικής Θεωρίας εμπλουτίζεται το περιεχόμενό του για να αναδειχθεί και η κοινωνική διάσταση της οικονομίας.
9. Τι περιλαμβάνει η κάθε ομάδα Προσανατολισμού ;
Τα βασικά μαθήματα της κάθε ομάδας είναι τα ίδια με την αντίστοιχη σημερινή Ομάδα Προσανατολισμού, με εξαίρεση την αντικατάσταση των Λατινικών από το μάθημα της Κοινωνιολογίας.
Σύμφωνα με τον υπουργό Παιδείας η αντικατάσταση αυτή κρίθηκε απαραίτητη αφ' ενός γιατί από όλο το φάσμα των επιστημών του 1ου Επιστημονικού Πεδίου τα Λατινικά αφορούσαν μόνο τα Τμήματα Φιλολογίας και αφ' ετέρου γιατί με την εξαιρετικά περιορισμένη εξεταστέα ύλη τους προκαλούσαν στρεβλώσεις στην τελική βαθμολογία των υποψηφίων.
Επίσης, τα μαθήματα Νεοελληνική Γλώσσα και Νεοελληνική Λογοτεχνία ενοποιούνται στο μάθημα Νεοελληνική Γλώσσα και Γραμματεία, το οποίο είναι εξεταζόμενο για όλους τους υποψηφίους.
Η σημερινή Ομάδα Προσανατολισμού Θετικών Σπουδών διαιρείται σε δύο Ομάδες Προσανατολισμού, την Ομάδα Προσανατολισμού «Θετικές Σπουδές» και την Ομάδα Προσανατολισμού «Σπουδές Υγείας». Η πρώτη οδηγεί στο δεύτερο και η δεύτερη στο τρίτο Επιστημονικό Πεδίο.
Κάθε Ομάδα Προσανατολισμού περιλαμβάνει μόνο τα μαθήματα στα οποία οι υποψήφιοι θα εξεταστούν τόσο για το απολυτήριο όσο και για την εισαγωγή τους στην τριτοβάθμια εκπαίδευση.
10. Οι συντελεστές βαρύτητας;
Καταργούνται οι συντελεστές βαρύτητας. Όλα τα μαθήματα θα έχουν την ίδια ακριβώς βαρύτητα.
11. Ποια είναι τα υποχρεωτικά μαθήματα;
Για το ημερήσιο Γενικό Λύκειο προβλέπονται τρία υποχρεωτικά μαθήματα: το μάθημα της Νεοελληνικής Γλώσσας και Γραμματείας ενιαίο μάθημα για 6 ώρες, το μάθημα των Θρησκευτικών για 1 ώρα και το μάθημα της Φυσικής Αγωγής για 2 ώρες, ενώ για το εσπερινό Γενικό Λύκειο προβλέπονται δύο μαθήματα Γενικής Παιδείας, Νεοελληνική Γλώσσα (6 ώρες) και Θρησκευτικά (1 ώρα).
12. Τι θα ισχύσει για τα ειδικά μαθήματα;
Επιπλέον για το ημερήσιο Γενικό Λύκειο προβλέπονται δύο διδακτικές ώρες για ένα μάθημα επιλογής. Στις επιλογές περιλαμβάνονται ειδικά μαθήματα που οι υποψήφιοι μπορεί να χρειαστούν και για την εισαγωγή τους σε κάποια Τμήματα.
13. Η ύλη των μαθημάτων θα αυξηθεί;
Η ύλη θα αυξηθεί σε κάποια μαθήματα, αλλά σε καμία περίπτωση αναλογικά με την αύξηση ωρών.
14. Θα υπάρξουν τρίμηνα ή τετράμηνα;
Θα υπάρχουν οι βαθμοί των τετραμήνων οι οποίοι θα προσδιορίζονται όπως περίπου προσδιορίζονται και σήμερα, εκτός προφανώς τη Φυσική Αγωγή, δε θα μετράει στον υπολογισμό των βαθμών των τετραμήνων.
Οι βαθμοί των τετραμήνων θα διαμορφώνονται για όλα τα μαθήματα εκτός της Φυσικής Αγωγής, από ωριαία διαγωνίσματα και εργασίες, όπως συμβαίνει και σήμερα.
Οι γραπτές ενδοσχολικές απολυτήριες εξετάσεις του Ιουνίου θα γίνονται στα τέσσερα εξάωρα μαθήματα (βλπ. παραπάνω), τα ίδια στα οποία θα εξετάζονται στη συνέχεια όσοι επιλέξουν να συμμετάσχουν στις πανελλαδικές εξετάσεις.
15. Οι ενδοσχολικές απολυτήριες εξετάσεις κάθε πότε θα γίνονται;
Οι γραπτές ενδοσχολικές απολυτήριες εξετάσεις του Ιουνίου θα γίνονται στα τέσσερα εξάωρα μαθήματα , τα ίδια στα οποία θα εξετάζονται στη συνέχεια όσοι επιλέξουν να συμμετάσχουν στις πανελλαδικές εξετάσεις.
16. Από ποιους θα επιλέγονται τα θέματα των ενδοσχολικών εξετάσεων;
Τα σχολεία θα χωριστούν σε ομάδες, ανά Δήμο στις μεγάλες πόλεις και ανά Νομό στην επαρχία. Τα θέματα σε κάθε εξεταζόμενο μάθημα θα προετοιμάζονται από ομάδα διδασκόντων όλων των σχολείων ανά ομάδα και το τελικό διαγώνισμα θα προκύπτει μετά από κλήρωση ομάδας θεμάτων μέσα από ένα μεγαλύτερο πλήθος. Τα θέματα θα στέλνονται ηλεκτρονικά στους μαθητές των σχολείων της συγκεκριμένης ομάδας και η εξέταση θα είναι δίωρη.
17. Επιτηρητές ποιοι θα είναι;
Επιτηρητές θα είναι οι καθηγητές των δημόσιων σχολείων αλλά διαφορετικής ειδικότητας από την ειδικότητα των καθηγητών του εξεταζόμενου μαθήματος.
18. Στα ιδιωτικά σχολεία;
Στα ιδιωτικά σχολεία οι επιτηρητές θα είναι ένας από το δημόσιο σχολείο και ένας από το ιδιωτικό σχολείο.
19. Τα γραπτά των μαθητών από ποιους εκπαιδευτικούς θα διορθώνονται;
Τα γραπτά των μαθητών, αφού καλυφθούν τα ονόματα, θα βαθμολογούνται από καθηγητή άλλου γειτονικού σχολείου.
20. Πως θα προκύπτει ο βαθμός του Απολυτηρίου;
Ο βαθμός για κάθε γραπτώς εξεταζόμενο μάθημα θα προκύπτει με βαρύτητα 40% για την τελική ενδοσχολική εξέταση και 60% για τον βαθμό των δύο τετραμήνων. Για τα άλλα μαθήματα, ο τελικός βαθμός θα προκύπτει κατά 100% από τον βαθμό των δύο τετραμήνων. Ο βαθμός του απολυτηρίου θα προκύπτει από τον μέσο όρο όλων των μαθημάτων που θα διδάσκονται στην Γ ́ Λυκείου.
21. Πως θα γίνεται η εισαγωγή στα ΑΕΙ;
Αμέσως μετά την ολοκλήρωση της Β’ Λυκείου (τον Ιούλιο), όλοι οι μαθητές που επιθυμούν να συνεχίσουν τις σπουδές τους στην τριτοβάθμια εκπαίδευση υποχρεούνται να συμπληρώσουν Α’ δήλωση προτίμησης (μηχανογραφικό) με τις 10 προτιμήσεις Τμημάτων στα οποία επιθυμούν να φοιτήσουν.
Αυτό θα το κάνουν για πρώτη φορά οι μαθητές που θα φοιτήσοουν τη νέα σχολική χρονιά στη Β Λυκείου.
22. Οι μαθητές της Β Λυκείου που δεν θα κάνουν την Α δήλωση χάνουν δικαιώματα;
Οι μαθητές που δε θα υποβάλουν την Α ́ δήλωση του Ιουλίου χάνουν το δικαίωμα εισαγωγής στην τριτοβάθμια εκπαίδευση, με ή χωρίς πανελλαδικές εξετάσεις για τη χρονιά αυτή.
Ο αριθμός 10 είναι ενδεικτικός, αλλά τα μοντέλα τα οποία έχει επεξεργαστεί το ΥΠΠΕΘ δείχνουν ότι δεν μπορεί να είναι ούτε πολύ μικρότερος, ούτε πολύ μεγαλύτερος.
23. Θα υπάρξει πρόγραμμα Συμβουλευτικής και Επαγγελματικού Προσανατολισμού προς τους μαθητές της Β. Λυκείου;
Η δυνατότητα των αποφοίτων της Β’ Λυκείου να συμπληρώσουν ένα πρώτο μηχανογραφικό με περιορισμένο αριθμό προτιμήσεων αποτελεί μία εξαιρετική ευκαιρία ωρίμανσης των προβληματισμών και της στοχοθεσίας τους.
Η συμπλήρωση της δήλωσης προτίμησης θα αποτελεί την κατάληξη προγράμματος Συμβουλευτικής και Επαγγελματικού Προσανατολισμού, το οποίο θα πραγματοποιείται μέχρι τη λήξη των προαγωγικών εξετάσεων της Β ́ Λυκείου.
Με τον τρόπο αυτόν θα προηγείται η ενημέρωση και η συμβουλευτική και θα ακολουθεί η συμπλήρωση του μηχανογραφικού.
Σ' αυτή τη διαδικασία συμπλήρωσης του μηχανογραφικού πρωτεύοντα ρόλο θα διαδραματίσουν οι εκπαιδευτικοί, οι οποίοι, γνωρίζοντας τις επιδόσεις και κλίσεις των μαθητών, θα μπορούν να τους προσανατολίσουν καταλλήλως.
24. Πως θα γνωρίζει ο μαθητής τα τμήματα που μπορεί να εγγραφεί χωρίς Πανελλαδικές και αυτά που θα πρέπει να εισαχθεί μέσω Πανελλαδικών;
Με βάση τις προτιμήσεις των μαθητών και τον αριθμό εισακτέων που θα έχει αποφασιστεί ανά Τμήμα, θα προκύψει ένας αριθμός Τμημάτων για τα οποία ο αριθμός των προτιμήσεων θα είναι ίσος ή μικρότερος από τον αριθμό εισακτέων. Αυτά τα Τμήματα, στα οποία ο αριθμός των αιτήσεων υπολείπεται των διαθέσιμων θέσεων, ονομάζονται «Τμήματα ελεύθερης πρόσβασης» (ΤΕΠ).
Τα υπόλοιπα Τμήματα, δηλαδή εκείνα στα οποία ο αριθμός των αιτήσεων υπερβαίνει τις διαθέσιμες θέσεις, ονομάζονται «Τμήματα πρόσβασης μόνο με πανελλαδικές εξετάσεις» (ΤΠΠΕ).
25. Και πότε ενημερώνονται οι μαθητές γι αυτά τα τμηματα;
Λίγες μέρες αργότερα, ο μαθητής ενημερώνεται για το ποιες από τις προτιμήσεις του αντιστοιχούν σε ΤΠΠΕ και ποιες σε ΤΕΠ. Από το σύνολο των δηλώσεων θα προκύψουν:
(1) Αυτές στις οποίες θα συμπεριλαμβάνεται ένα τουλάχιστον ΤΕΠ και,
(2) Αυτές στις οποίες όλα τα Τμήματα είναι ΤΠΠΕ.
26. Πότε θα γίνουν οι Πανελλαδικές;
Οι μαθητές της κατηγορίας ΤΠΠΕ, θα διαγωνιστούν στις πανελλαδικές για την εισαγωγή τους στην Ανώτατη Εκπαίδευση μιας και από τις προτιμήσεις τους στη δήλωση του Ιουλίου δεν έχει προκύψει κανένα «Τμήματα ελεύθερης πρόσβασης» (ΤΕΠ).
27. Πότε θα δηλώσουν οι μαθητές της κατηγορίας ΤΕΠ δηλώνουν αν θα συμμετάσχουν στις πανελλαδικές;
Τον Φεβρουάριο, οι μαθητές της κατηγορίας ΤΕΠ δηλώνουν αν θα συμμετάσχουν στις πανελλαδικές εξετάσεις ή αν προτιμούν να εισαχθούν σε ένα από τα ΤΕΠ που είχαν
συμπεριλάβει στην αρχική τους δήλωση.
Η δήλωση του Φεβρουαρίου είναι οριστική και δεσμευτική. Συγκεκριμένα, ένας μαθητής που είχε τουλάχιστον ένα ΤΕΠ στη δήλωση του Ιουλίου μπορεί:
(α) να επιλέξει εισαγωγή σε ΑΕΙ μέσω πανελλαδικών εξετάσεων, χάνοντας το δικαίωμα πρόσβασης σε κάποιο από τα ΤΕΠ που είχε δηλώσει ή,
(β) να επιλέξει ένα από τα ΤΕΠ που είχε συμπεριλάβει στη δήλωση του Ιουλίου, οπότε εισάγεται στο Τμήμα αυτό, με μόνη προϋπόθεση την απόκτηση του απολυτηρίου της Γ ́ Λυκείου.
28. Πως θα διαμορφωθεί η τελική βαθμολογία του μαθητή που δήλωσε ότι θα συμμετάσχει στις Πανελλαδικές;
Για τους μαθητές που θα διαγωνιστούν στις πανελλαδικές, ο βαθμός των πανελλαδικών εξετάσεων θα διαμορφωθεί κατά 90% από τον μέσο όρο των βαθμών τους στα πανελλαδικώς εξεταζόμενα μαθήματα και κατά 10% από τον βαθμό του απολυτηρίου.
Η ποσόστωση αυτή προτείνεται να ισχύσει το πρώτο έτος εφαρμογής του νέου συστήματος, δηλ. στις πανελλαδικές εξετάσεις του 2020.
Όσο το σύστημα καθιερώνεται και ενισχύεται, το ποσοστό του βαθμού του απολυτηρίου θα αυξάνεται σταδιακά.
Σάββατο 8 Δεκεμβρίου 2018
Σάββατο 1 Δεκεμβρίου 2018
Παρασκευή 16 Νοεμβρίου 2018
Εγκρίθηκε η αναθεώρηση του ορισμού του «κιλού»

Άλλη μία αποκαθήλωση πέρασε στην ιστορία: Το «αληθινό» κιλό, ένας κύλινδρος από κράμα πλατίνας και ιριδίου, που εδώ και 130 χρόνια ήταν το παγκόσμιο πρότυπο για τη μέτρηση της μάζας, έπαψε πια να αποτελεί το σημείο αναφοράς για τον ορισμό του κιλού.
Οι αντιπρόσωποι από τα 60 κράτη-μέλη του Διεθνούς Γραφείου Μέτρων και Σταθμών (ΒΙΡΜ), που συνήλθαν αυτήν την εβδομάδα στις Βερσαλλίες της Γαλλίας, στο πλαίσιο της 26ης Γενικής Συνδιάσκεψης για τα Μέτρα και τα Σταθμά (CGPM), αναθεώρησαν ξανά το Διεθνές Σύστημα Μονάδων (SI) και ενέκριναν σήμερα -διά ψηφοφορίας- την αναθεώρηση του ορισμού του κιλού, σύμφωνα με το BBC και τους «Τάιμς της Νέας Υόρκης».
H αναθεώρηση -που θα τεθεί επίσημα σε ισχύ στις 20 Μαΐου του 2019- είχε ως στόχο τέσσερις από τις βασικές μονάδες του συστήματος -το χιλιόγραμμο ή κιλό (μονάδα μέτρησης της μάζας), το αμπέρ (μονάδα μέτρησης της έντασης του ηλεκτρικού ρεύματος), το κέλβιν (μονάδα μέτρησης της θερμοκρασίας) και το γραμμομόριο (μονάδα μέτρησης για την ποσότητα ύλης ενός σώματος)- έτσι ώστε να ορίζονται πλέον έμμεσα, με όρους κάποιας φυσικής σταθεράς.
Συγκεκριμένα, το κιλό θα ορίζεται πλέον με βάση την κβαντική Σταθερά Πλανκ, τη μικρότερη δυνατή μονάδα ενέργειας που δεν αλλάζει ποτέ και από την οποία μπορεί να προκύψει η μάζα σύμφωνα με τη θεωρία του Αϊνστάιν για τη σχέση μάζας-ενέργειας. Το αμπέρ θα ορίζεται με βάση το φορτίο τού ηλεκτρονίου, το κέλβιν με βάση τη Σταθερά Μπόλτζμαν και το γραμμομόριο με βάση τη Σταθερά Αβογκάντρο.
Είχε προηγηθεί τα προηγούμενα χρόνια μία ανάλογη αναθεώρηση για τις άλλες τρεις βασικές μονάδες του συστήματος SI: Το μέτρο (μονάδα μέτρησης της απόστασης), το δευτερόλεπτο (μονάδα μέτρησης του χρόνου) και το κηρίο ή καντέλα (μονάδα μέτρησης της έντασης μίας φωτεινής πηγής).
Μέχρι σήμερα το πρότυπο του κιλού, το λεγόμενο και μόνο «αληθινό» κιλό ή «Το Μεγάλο Κ» (Le Grand K), που χρησιμοποιείται από το 1889, φυλάσσεται σε ένα εργαστήριο στο κτίριο του Διεθνούς Γραφείου Μέτρων και Σταθμών (το οποίο είχε ιδρυθεί το 1875), στις Σέβρες της Γαλλίας. Ο εν λόγω εμβληματικός λαμπερός κύλινδρος -που διεκδικούσε το δικαίωμα να αποκαλείται το μοναδικό αληθινό κιλό στον κόσμο- αποτελεί το τελευταίο υλικό κατασκεύασμα που ακόμη χρησιμοποιείτο για τον ορισμό μίας μονάδας του συστήματος SI.
Η αναθεώρηση έχει ως στόχο να κάνει τις μονάδες μέτρησης πιο σταθερές και αξιόπιστες σε βάθος χρόνου, συνδέοντας τις μετρήσεις στο μικροσκοπικό επίπεδο (ατομικό και κβαντικό) με τις μετρήσεις στο μακροσκοπικό επίπεδο.
Τετάρτη 14 Νοεμβρίου 2018
Πανελλήνιες Εξετάσεις, Σπουδές και Brain Drain
Δυο από τα βασικά αγωνιώδη ερωτήματα για κάθε λογικά σκεπτόμενο πολίτη αυτής της χώρας είναι τα εξής, μεταξύ πολλών άλλων; Αντέχουμε και άλλη πνευματική διαρροή (brain drain) υψηλά καταρτισμένων και εκπαιδευμένων νέων ανθρώπων ως χώρα και κατά δεύτερον θα μπορέσουμε πράγματι το brain drain να το μεταλλάξουμε σε brain gain;
Τα ερωτήματα αυτά δεν είναι ούτε ρητορικά ούτε φιλολογικά.. Είναι ίσως τα πιο ουσιώδη ερωτήματα που θα πρέπει να θέσουμε στους ίδιους τους εαυτούς μας συνυπολογίζοντας όρους οικονομικούς, ασφαλιστικούς, καινοτομίας και ανταγωνιστικότητας μεταξύ άλλων. Σε μια πρώτη ανάγνωση, άλλοι εντονότερα καθώς έχουν αποχωριστεί κάποιο οικείο πρόσωπο και άλλοι στο πλαίσιο μιας συλλογικής συνείδησης αναφέρονται στη δυσάρεστη πραγματικότητα του brain drain. Λίγοι όμως έχουμε αντιληφθεί δυο πολύ βασικές παραμέτρους του φαινομένου.

Η μια έχει να κάνει πως εξετάζοντας τα ποιοτικά χαρακτηριστικά των ανθρώπων που έχουν μεταναστεύσει, θα διαπιστώσουμε πως δεν πρόκειται απλά για ένα μεγάλο ποσοστό του εργατικού δυναμικού. Αντιθέτως, πρόκειται, σε μεγάλο βαθμό, για την «αφρόκρεμα» ενός νεανικού επιστημονικού δυναμικού με επίπεδο μόρφωσης που δεν διαθέτει απλά ένα πτυχίο τριτοβάθμιας εκπαίδευσης αλλά περιλαμβάνει πληθώρα εξειδικευμένων επιστημόνων με μεταπτυχιακές και διδακτορικές σπουδές. Ανθρωπίνου δυναμικού δηλαδή, το οποίο από την ατομική μας φορολογία έχουμε εκπαιδεύσει σε πολύ υψηλό βαθμό και με αξιόλογες ποιοτικές και ηλικιακές προδιαγραφές και το «στέλνουμε» στο εξωτερικό.
Η δεύτερη έχει να κάνει με ένα ιδιαίτερα «πρακτικό» και κοντινό δεδομένο του ζητήματος. Γερνάμε γρήγορα..Γρηγορότερα ελέω κρίσης.. Και τι σημαίνει αυτό; Χάνοντας ένα μεγάλο αριθμό νεανικού πληθυσμού πρακτικά δημιουργούμε ένα διττό πρόβλημα: Αποδυναμώνουμε ένα ήδη προβληματικό συνταξιοδοτικό σύστημα και παράλληλα έχουμε απολέσει τους παραδοσιακούς πυλώνες για καινοτομία και νεοφυή επιχειρηματικότητα που είναι οι νέοι και ταλαντούχοι άνθρωποι. Είναι πολλές και αξιόλογες οι μελέτες ως προς αυτά και εύκολα μπορούν να ανακτηθούν από το διαδίκτυο. Αλλά και η ίδια η κοινή λογική, αυταπόδεικτα αναλογιζόμενη αξιοθαύμαστες και αξιομνημόνευτες καταστάσεις τύπου Silicon Valley, γνωρίζει πως δεν υφίσταται παγκοσμίως κάποια Μέκκα της καινοτομίας και της τεχνολογίας με μέσο όρο ηλικίας 65αρηδες…
Τι σχέση έχουν οι Πανελλήνιες όμως με τα προαναφερθέντα; Ας ξεκινήσουμε από ένα κοινό τόπο που οι γνωρίζοντες θα συμφωνήσουν. Την ίδια ώρα που έχουμε στις περισσότερες ειδικότητες υψηλή ανεργία έχουμε και έλλειψη συγκεκριμένων ειδικοτήτων ή στελεχών με περιζήτητες δεξιότητες. Αν για παράδειγμα, για την εταιρεία σας θελήσετε να βρείτε έναν καλό data analyst ή να ακούσετε ευλαβικά τις συμβουλές ενός UX designer, θα διαπιστώσετε ότι το γραφείο σας δεν θα κατακλυστεί από δεκάδες βιογραφικά..

Οι Πανελλήνιες, τα τμήματα και όλοι οι εμπλεκόμενοι φορείς άμεσα και έμμεσα σχετίζονται με το brain drain και την εγχώρια αγορά εργασίας. Να ξεκαθαρίσουμε καταρχάς πως όλες οι επιστήμες και όλες οι ειδικότητες έχουν ρόλο και θέση σε κάθε πολιτισμένη κοινωνία. Ωστόσο, το δεδομένο πως, ενώ κατά μέσο όρο εισάγονται 4000 φιλόλογοι κάθε χρόνο στα ΑΕΙ μας, αλλά την ίδια στιγμή δεν υπάρχει τμήμα π.χ. Φιλολογίας ή Εκπαίδευσης Διαπολιτισμικής από μόνο του είναι ένα θέμα. Την ίδια στιγμή που έχουμε πολλά τμήματα Δασκάλων και Νηπιαγωγών, δεν έχουμε εξειδικευμένο τμήμα πρωτοβάθμιας εκπαίδευσης διαπολιτισμικής ή/και πολιτισμικής εξειδίκευσης επίσης είναι ένα θέμα. Επιπρόσθετα, το γεγονός πως προβλέπονται τμήματα για στελέχη ειδικής αγωγής στην πρωτοβάθμια αλλά δεν υπάρχουν αντίστοιχα τμήματα για εκπαιδευτικούς ειδικής αγωγής στην δευτεροβάθμια επίσης είναι ένα πρακτικό και ουσιαστικό ζήτημα. Είναι σαν να υποθέτουμε πως για όλα αυτά τα παιδιά που εντάσσονται στα πεδία της Ειδικής Αγωγής και Εκπαίδευσης, η φοίτηση και η υποστήριξη είναι αναγκαία και απαραίτητη μόνο στην πρωτοβάθμια εκπαίδευση. Από κει και πέρα περιττή..
Τα παραδείγματα είναι πολλά. Να αναφέρουμε ενδεικτικά ότι μόλις πέρυσι ενταχθήκαν Πανεπιστημιακά τμήματα για το πεδίο του τουρισμού ενώ φέτος, μετά από αρκετά χρόνια επαναλειτουργεί η σχολή Ξεναγών, σχολές και ειδικότητες που σχετίζονται με ένα από τους βασικούς πυλώνες της χώρας μας. Παράλληλα, κρίνεται σκόπιμο για ένα μακροπρόθεσμο και εύστοχο επανασχεδιασμό του ακαδημαϊκού χάρτη της χώρας να εντάξουμε και μια διεπιστημονικότητα στα προγράμματα σπουδών που θα καλύπτουν ακόμη περισσότερο τις νέες δεξιότητες που είναι αναγκαίες στο επιστημονικό και επαγγελματικό γίγνεσθαι παγκοσμίως. Για ποιο λόγο είναι παράδοξο ή αντισυμβατικό π.χ. ακόμη και σε κλασικές σπουδές να μην υπάρχουν σε μαθήματα εξαμήνου ενότητες επιχειρηματικότητας; Μήπως π.χ. κανείς απόφοιτος ποτέ δεν θα ξεκινήσει δικό του επιχειρείν με ένα φροντιστήριο; Για ποιο λόγο σε ένα τμήμα πληροφορικής να μην εντάσσονται συστηματικά και μαθήματα marketing ή HR καλλιεργώντας πέρα από τις τεχνικές γνώσεις και άλλες.

Η επανεξέταση των προγραμμάτων σπουδών, των τμημάτων και του συστήματος δεν πρέπει να αναλώνεται στη συζήτηση της αύξησης ή της μείωσης του αριθμού των εισαχθέντων ή των μαθημάτων αλλά και στις δυνατότητες και στη στοχοθεσία όλων αυτών που θα φοιτήσουν σε αυτά τα προγράμματα σπουδών. Όπως και δεν πρέπει εσφαλμένα να αναλώνεται μόνο στο αν χρειαζόμαστε περισσότερα ή λιγότερα τμήματα θετικού προσανατολισμού, θεωρητικού κ.λπ. Το ζήτημα είναι αν αυτό που παρέχουμε στην τριτοβάθμια εκπαίδευση ανταποκρίνεται στις μελλοντικές μας επιδιώξεις και βλέψεις ως χώρα, ως οικονομία, ως κοινωνία. Έστω και αν μελλοντικά ανακάμψει η χώρα μας και επέλθει η πολυπόθητη ανάπτυξη δεν θα πρέπει να μπούμε σε τέτοιους προβληματισμούς;
Σε καμία χώρα, σε καμία κοινωνία και σε καμία οικονομία όταν η εκπαίδευση παραμένει αμέτοχη στις απαιτήσεις των καιρών και στις ανάγκες των ανθρώπων δεν μπορεί να μακροημερεύσει ούτε η οικονομία ούτε και η ίδια η κοινωνία. Η εκπαίδευση συνολικά έχει πολλά να δώσει και πολλά να αλλάξει. Ωστόσο, αφού πάγια τακτική της εκάστοτε ηγεσίας του Υπουργείου Παιδείας είναι να εστιάζει στην αλλαγή του συστήματος και των Πανελληνίων, ευελπιστούμε πως κάποια στιγμή αυτή η αλλαγή θα είναι ουσιαστική, ανιδιοτελής και θα ακούσει τα προστάγματα των καιρών. Ας ξεκινήσουμε από κάπου..Γιατί αυτό το κάπου να μην είναι το σύστημα, η στοχοθεσία που πρακτικά θα βάλουμε για το εξεταστικό και τις ανακατατάξεις στα ΑΕΙ και γιατί να μην είναι αποτελέσει το εφαλτήριο για μια ακόμη μεγαλύτερη βελτίωση του εκπαιδευτικού συστήματος.
Το να βοηθήσουμε τους νέους να σπουδάσουν και να καλλιεργήσουν γνώσεις που θα μπορούν ευκολότερα να αξιοποιήσουν στις υπάρχουσες και μελλοντικές εσωτερικές συνθήκες της χώρας μας ίσως να είναι το πρώτο βήμα να αμβλύνουμε μελλοντικά το brain drain. Το να βελτιώσουμε μετέπειτα όλες αυτές τις συνθήκες που θα προσελκύσουν όλους αυτούς τους νέους ανθρώπους που έφυγαν στο εξωτερικό, ας είναι το επόμενο και μεγάλο στοίχημα για όλους. Γιατί είναι και θα είναι το μεγάλο στοίχημα. Ένα στοίχημα στο οποίο όμως υπάρχουν δυο μόνο «αποδόσεις»: ή θα πάρουμε υπεραξίες ή θα χάσουμε τα πάντα και πολύ πιο γρήγορα από όσο φανταζόμαστε.
Σύνταξη: Δρ Χρήστος Ταουσάνης, σύμβουλος σταδιοδρομίας & Επιστημονικός Διευθυντής Employ | www.e-employ.gr
Εγγραφή σε:
Αναρτήσεις (Atom)






