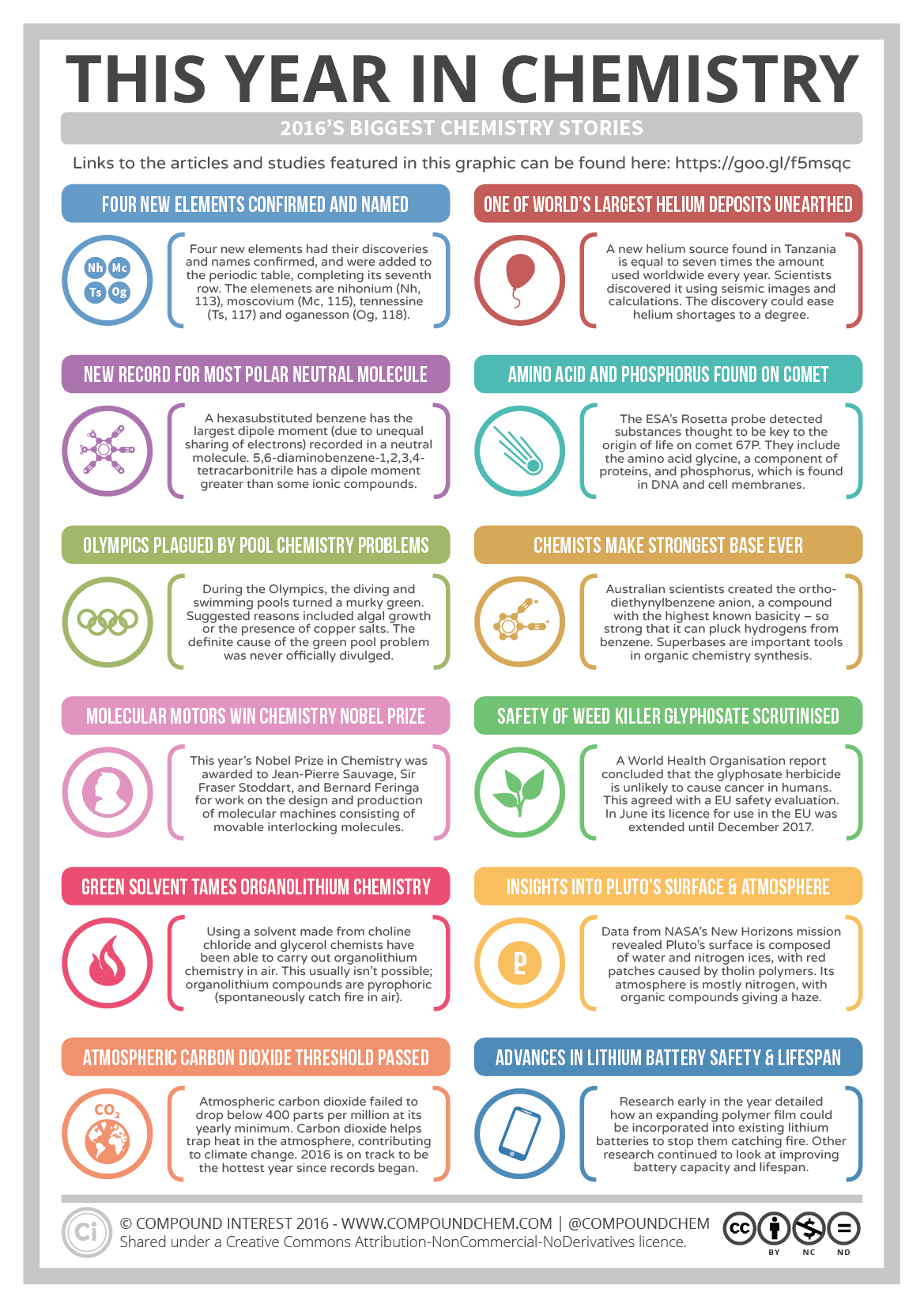
Η Διεθνής Ένωση Καθαρής και Εφαρμοσμένης Χημείας (IUPAC) ανακοίνωσε ότι, έπειτα μετά από πεντάμηνη δημόσια διαβούλευση, ενέκρινε και επίσημα τα ονόματα τεσσάρων νέων χημικών στοιχείων όπως είχαν προταθεί από τους δημιουργούς τους.
Μέχρι τώρα τα στοιχεία αυτά αναφέρονταν μόνο ως ατομικοί αριθμοί: 113, 115, 117 και 118.
Τα επίσημα πλέον ονόματα και αντίστοιχα σύμβολα για κάθε στοιχείο είναι: για το 113 νιχόνιο (Nh), για το 115 μοσκόβιο (Mc), για το 117 τενεσίνο (Ts) και για το 118 ογκάνεσον (Og).
Συμπληρώνεται η έβδομη σειρά του Περιοδικού Πίνακα
Πρόκειται για πολύ βαριά στοιχεία, τα οποία είναι τα πρώτα που προστίθενται στον Περιοδικό Πίνακα μετά το 2011 και συμπληρώνουν την έβδομη σειρά του.
Και τα τέσσερα δημιουργήθηκαν από επιστήμονες μέσω βομβαρδισμού ελαφρύτερων ατομικών πυρήνων.
Κανένα δεν υπάρχει στη φύση, αφού όλα διασπώνται σε ελαφρύτερα στοιχεία μέσα σε κλάσματα του δευτερολέπτου. Κανένα στοιχείο βαρύτερο από το ουράνιο (με 92 πρωτόνια και 146 νετρόνια) δεν έχει παρατηρηθεί εκτός εργαστηρίου.
Πώς έλαβαν τα ονόματά τους
Παραδοσιακά, οι επιστήμονες που ανακαλύπτουν ένα στοιχείο έχουν και το δικαίωμα να προτείνουν το όνομά του. Το νιχόνιο, που ανακαλύφθηκε στον ιαπωνικό επιταχυντή RIKEN, παίρνει της Ιαπωνίας στα ιαπωνικά («χώρα του ανατέλλοντος ηλίου»).
Το μοσκόβιο, που ανακαλύφθηκε από το ρωσικό Κοινό Ινστιτούτο Πυρηνικών Ερευνών Ντούμπνα, φέρει το όνομα της Μόσχας.
Το τενεσίνο, που βρέθηκε από το Εθνικό Εργαστήριο Όουκ Ριτζ και το Πανεπιστήμιο Βάντερμπιλτ του Τενεσί, παραπέμπει στο όνομα της συγκεκριμένης πολιτείας των ΗΠΑ.
Το ογκάνεσον φέρει το όνομα του ρώσου καθηγητή πυρηνικής φυσικής Γιούρι Ογκανεσιάν, ο οποίος έπαιξε καθοριστικό ρόλο στην ανακάλυψή του.